 |
 |
AbstractPurposeTo identify the differences in features between children with urinary tract infection (UTI) caused by extended-spectrum beta-lactamases (ESBL)-positive and -negative Escherichia coli, and analyze risk factors for the former infection.
MethodsWe reviewed medical records of children younger than 36 months with E. coli UTI who visited the emergency department from January 2012 through January 2019. Differences in variables regarding clinical, laboratory, and microbiologic (i.e., ESBL-positive E. coli on urine culture) features, and outcomes between the ESBL-positive and -negative groups were identified. Factors associated with ESBL-positive E. coli infection were analyzed by logistic regression.
ResultsThe children were classified into the ESBL-positive (n = 151) and -negative (n = 40) groups. The former group showed higher frequency of prior UTI (P = 0.038) without other differences between the groups. The median counts of white blood cells, absolute neutrophils, and absolute lymphocytes were higher in the ESBL-positive group than in the other group (P = 0.009, 0.022, and 0.027, respectively). The former group showed longer median hospital length of stay (11.0 days [interquartile range, 8.9-12.0] vs. 6.0 [5.0-7.0]; P < 0.001), and more frequent recurrence per child (3.0 [2.5-3.0] vs. 1.0 [1.0-1.8]; P = 0.047) and presence of vesicoureteral reflux (27.5% vs. 13.2%; P = 0.001). Logistic regression showed leukocytosis (odds ratio, 12.85; 95% confidence interval, 1.04-157.69) and vesicoureteral reflux (4.00; 1.19-13.43) as the factors for ESBL-positive E. coli infection.
서론요로감염은 열을 주소로 응급실을 방문하는 소아환자 퇴원 진단의 5% 이상을 차지한다[1-3]. 대표적 병원체는 대장균으로, 경험적 항균제로 3세대 세팔로스포린 또는 아미노글리코사이드 중 의사 판단에 따라 적절히 택일하여 투여하도록 권고한다[4-6]. 그러나 새 항균제 개발 및 사용이 증가하면서 요로감염 원인균 조성 및 항균제 감수성이 변하고, 특히 광범위 세팔로스포린에 대한 다약제내성균 감염이 증가하고 있다[7,8]. 2019년 한국의 전국 역학 조사연구에 따르면, 다약제내성균 감염 빈도가 2012년 4%에서 2017년 36.5%로 증가했다[9].
대상과 방법1. 연구대상본 연구는 연 2,000명 이상의 소아응급환자가 방문하는 한국 광역시 소재 단일 상급종합병원에서 2012년 1월부터 2019년 1월에 방문한 환자를 대상으로 시행했다. 상기 기간에 요로감염 과거력과 무관하게, 열로 본원을 방문하여 요배양을 통해 대장균 요로감염으로 진료받은 36개월 미만 환자를 대상으로 했다. 기저 질환 및 선천 비뇨기 기형 유무와 무관하게 대상자를 선정했고, 치료 전 비뇨계 수술적 치료를 받은 환자는 1명도 없었다. 치료 시작 전 외부병원으로 이송됐거나 외래 추적이 중단된 환자는 제외했다. 본 연구는 본원 임상연구심의위원회의 승인을 얻고 진행했다(IRB no. DAUHIRB-19-219).
2. 정의요로감염은 도뇨관으로 채취한 검체를 이용한 요배양에서 단일 세균이 105 colony-forming unit/mL 이상 확인된 경우로 정의했다. 현미경 검사를 위해, 검체를 원심 분리 및 그람 염색하여 세균 및 백혈구를 관찰하였다. 소변 배양은 소변 0.001 mL를 혈액 한천 배지 및 Triple Sugar Iron, MacConkey 한천 배지에 개별적으로 접종하고 37℃에서 18-24시간 배양 후 1 mL 당 집락 수를 계산했다. 그람 염색으로 분리한 균주 중 대장균이 단일 균주로 의미 있게 나온 경우만 대장균 요로감염으로 정의했고, ESBL 생성 여부에 따라 ESBL 양성군 및 음성군으로 나눴다.
열 지속기간(일)은 환자 또는 보호자가 열을 처음 인지한 시점부터 방문 후 체온이 마지막으로 38.3℃ 이상이던 시점까지 기간으로 정의했다. 최고 체온은 보호자가 보고한 값과 의료진이 측정한 값 중 더 높은 것으로 정의했다. 중증감염은 활력징후 감시, 산소요법, 승압제, 중환자실 치료가 필요한 경우 또는 사망으로 정의했다.
3. 방법의무기록을 토대로 자료를 후향적으로 수집∙분석했다. 진단 당시 나이(월), 성별, 열 지속기간, ESBL 양성 여부, 입원 시 영상검사 결과(초음파, 스캔, 배뇨방광요도조영), 항균제 종류 및 변경, 입원 기간(일), 재발(2회 이상 재발 환자는 첫 재발만 포함), 추적 기간(일) 등을 분석했다. 검사실검사로 전체혈구계산, 절대중성구계산, C-반응단백질 등 염증표지자 항목을 포함했다. 그리고 동반 비뇨기 기형, 수신증 및 신장흉터 유무, 비뇨계 수술 여부 및 시기를 조사했다. 방광요관역류 및 신장흉터는 본원 방문 전 진단된 경우를 포함하여 분석했다.
ESBL 양성군 및 음성군 간 임상적 특성의 차이를 통계적으로 분석하기 위해, 연속형 변수에 대해 Mann-Whitney U test를, 범주형 변수에 대해 chi-square test 또는 Fisher exact test를 각각 사용했다. 해당 분석에서 유의하게 나온 변수를 이용하여 로지스틱 회귀분석으로 단변수 및 다변수 분석을 시행하여 교차비를 구했으며, P가 0.05 미만인 경우를 통계적 유의성이 있는 것으로 정의했다. 상기 분석에 IBM SPSS Statistics, ver. 24.0 (IBM Corp., Armonk, NY)을 사용했다.
결과1. 연구대상자의 일반적 특성연구기간에 본원 응급실에서 요로감염으로 진단받고 입원한 환자 229명 중 36개월 미만은 총 191명이었다. 이 연구대상자의 본원 입원 및 추적기간의 중앙값은 각각 6.0일(사분위수 범위, 5.0-8.0) 및 109.0일(17.0-269.5)이었으며, 남자가 68.1%를 차지했다. ESBL 양성군으로 분류된 환자는 40명(20.9%)이었다. 연도별로, ESBL 양성균 감염은 전반적인 증가 추세를 보였다(Fig. 1).
2. ESBL 양성군 및 음성군의 임상적 특성진단 당시 나이의 중앙값은 3.6개월(사분위수 범위, 2.4-5.6)로, ESBL 양성군 환자의 나이 중앙값이 음성군보다 더 많은 경향을 보였다(3.5개월[2.2-5.4] vs. 4.5 [2.5-6.8]) (Table 1, Appendix 1, https://doi.org/10.22470/pemj.2020.00045). 그러나 요로감염 과거력을 가진 환자는 양성군에서 유의하게 많았다. 열 지속기간, 최고 체온, 기타 각종 동반 임상증상의 빈도는 두 군 간의 차이가 없었다. 백혈구 수, 절대중성구 수, 절대림프구 수는 ESBL 양성군에서 음성군보다 유의하게 많았다(Table 2). 그러나 C-반응단백질 등 다른 염증표지자는 두 군 간에 유의한 차이가 없었다.
3. 치료 결과ESBL 양성군의 입원 기간 중앙값이 유의하게 더 길었다(Table 3). 요로감염 재발 빈도는 두 군 간의 차이가 없었지만, 환자 1인당 재발 횟수는 양성군에서 더 많았다. 또한, 이 군에서 방광요관역류 빈도가 더 높았다. 수신증 및 신장흉터 빈도는 두 군 간에 유의한 차이가 없었다. 연구대상자 중 중증감염은 없었다.
본 연구에서는 103명(53.9%)이 경험적 항균제로 3세대 세팔로스포린을, 나머지가 아미노글리코사이드를 각각 투여받았다(Fig. 2).
4. ESBL 양성균 감염의 위험인자단변수 분석에서 절대 림프구 수, 방광요관역류, 높은 백혈구 수, 요로감염 과거력, 절대중성구 수가 ESBL 양성균 감염과 연관을 보였다. 다변수 분석에서는, 높은 백혈구 수(교차비, 12.85; 95% 신뢰구간, 1.04-157.69)와 방광요관역류(4.00; 1.19-13.43)만이 ESBL 양성균 감염의 유의한 위험인자로 나타났다(Table 4).
고찰본 연구는 ESBL 양성균 감염 환자가 음성균 감염 환자와 다르게 지닌 임상적 특성을 분석함으로써, 초기에 양성균 감염을 예측하는 위험인자를 찾았다는 의의가 있다.
최근 연구에 의하면, ESBL 양성균 등 다약제내성균에 의한 균혈증에서 사망률이 높은 것과 달리[13-16], 요로감염에선 비교적 사망률이 낮고 상기 감염이 있어도 초기 치료가 적절히 이뤄지면 중증감염으로 진행하는 빈도가 낮다[17-19]. 본 연구에서 열과 관련한 특성은 ESBL 양성군 및 음성군 간에 유의한 차이가 없었고, 두 군 모두에서 중증감염은 발생하지 않았다. 하지만, 양성군에서 백혈구 수, 절대중성구 수, 절대림프구 수가 유의하게 높은 수치를 보였고, 이 중 높은 백혈구 수가 위험인자로 나타났다. 이는 양성균 감염에서 염증이 더 심했음을 시사한다. 따라서, 임상증상 및 혈액검사에서 백혈구 수가 많고 아파 보이면 다약제내성균 감염을 고려해야 한다.
ESBL 양성군에서 방광요관역류 빈도가 높았고, 유의한 위험인자로 나타났으므로, 방광요관역류와 같은 비뇨기 기형이 있는 환자에서 상기 세균에 의한 요로감염으로 가정하고 경험적 항균제 선택에 이를 반영해야 한다. 재발 빈도는 두 군 간의 차이가 없었으나, 양성군에서 환자 1인당 재발 횟수가 더 많았다. 이 차이가 다변수 분석에서 유의하지 않았던 것은 재발 환자가 총 15명으로, 통계적 분석이 제한된 것과 연관됐다고 추정한다. 또한, 기존 연구에 의하면 ESBL 양성균 요로감염 환자는 재발 시에도 양성균 감염일 확률이 높았는데[20,21], 본 연구에서도 양성군에서 재발한 환자 6명 중 5명이 재발 시에도 양성균 감염이었다(Table 5). 이 결과가 유의하지 않은 것도 적은 재발 환자 수와 연관된 것으로 추정한다. 따라서, ESBL 양성균 감염의 과거력을 같은 세균감염의 위험인자로 추정할 수 있다. 앞으로 더 많은 환자를 대상으로 한 연구를 통해 검증할 필요가 있을 것으로 생각한다.
본 연구에서 연구대상자의 53.9% (103명)가 경험적 항균제로 세팔로스포린을 투여받았고, 이 중 ESBL 양성군에 해당하는 22명(21.4%)에 대한 항균제 선택은 결과적으로 부적절했다고 해석할 수 있다(Fig. 2). 최근 미국, 이탈리아, 스페인 등에서 발표한 논문에서도[8,22-25] ESBL 양성균 감염이 증가 추세이므로, 요로감염의 경험적 항균제로 아미노글리코사이드, piperacillin-tazobactam, 카바페넴 등 비(非)세팔로스포린 항균제를 선택하는 것을 권고하기도 한다[8,11,22-27]. 또한, 본 연구에서 ESBL 양성군에서 입원 기간이 더 길었다. 이는 양성균 감염 확인 후, 가능하면 감수성 항균제로 바꾸고, 그렇지 않으면 항균제 주사요법을 권고 기간에 따라 시행했기 때문으로 추정한다. 스페인과 방콕의 연구에서도 이러한 ESBL 양성균 감염으로 인한 입원 기간 연장 또는 불필요한 항균제 추가 등으로 인한 의료비 증가 문제가 제기됐다[24,26]. 감수성 결과가 나오는 시간을 단축하기 어렵다면, 응급실에서 요로감염 환자의 경험적 항균제 결정에 대한 새로운 기준을 정립해야 한다.
본 후향적 연구의 제한점은 연구대상자가 체계적인 영상 검사를 받지 못하여, 신장스캔을 시행한 환자에게서만 수신증 및 신장흉터 발생 여부를 확인할 수 있었다는 점이다. 향후 신장흉터 및 신부전 등 장기 합병증과 ESBL 양성균 감염의 연관을 분석하려면 더 많은 환자를 대상으로 한 전향적 연구가 필요하다.
요약하면, 본 연구에서 많은 백혈구 수와 방광요관역류는 ESBL 양성균 감염의 위험인자로 나타났다. 따라서, 36개월 미만 열 동반 요로감염 환자가 이러한 임상적 특성을 보인다면 ESBL 양성균 감염을 의심하여 경험적 항균제를 선택해야 한다.
Fig. 1.Annual distribution of the children with urinary tract infection showing the increasing trend of the number of ESBL-producing Escherichia coli infection. ESBL: extended-spectrum beta-lactamases. 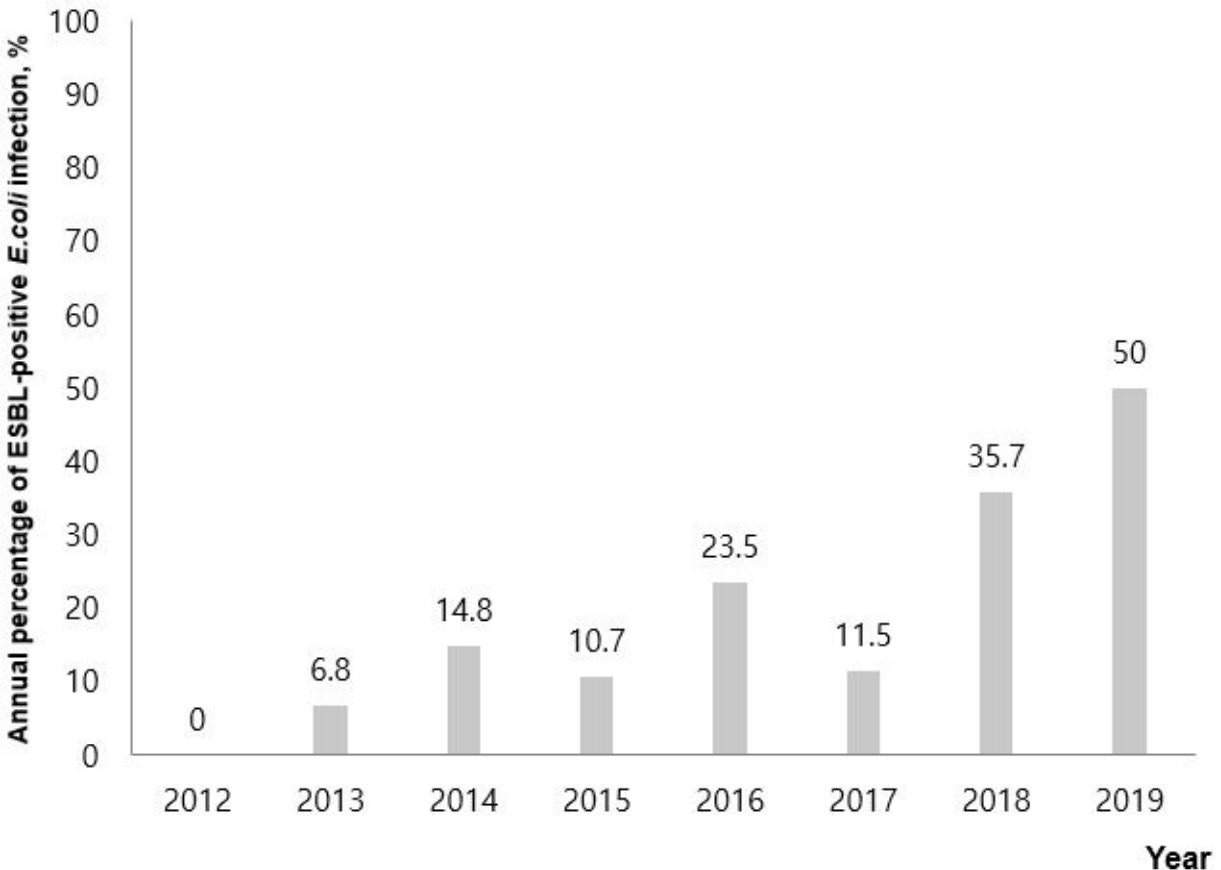
Fig. 2.Choice of empirical antibiotics. It is notable that 18 of the 40 children (45.0%) with ESBL-producing Escherichia coli infection underwent appropriate empirical antibiotic therapy. UTI: urinary tract infection, ESBL: extended-spectrum beta-lactamases. 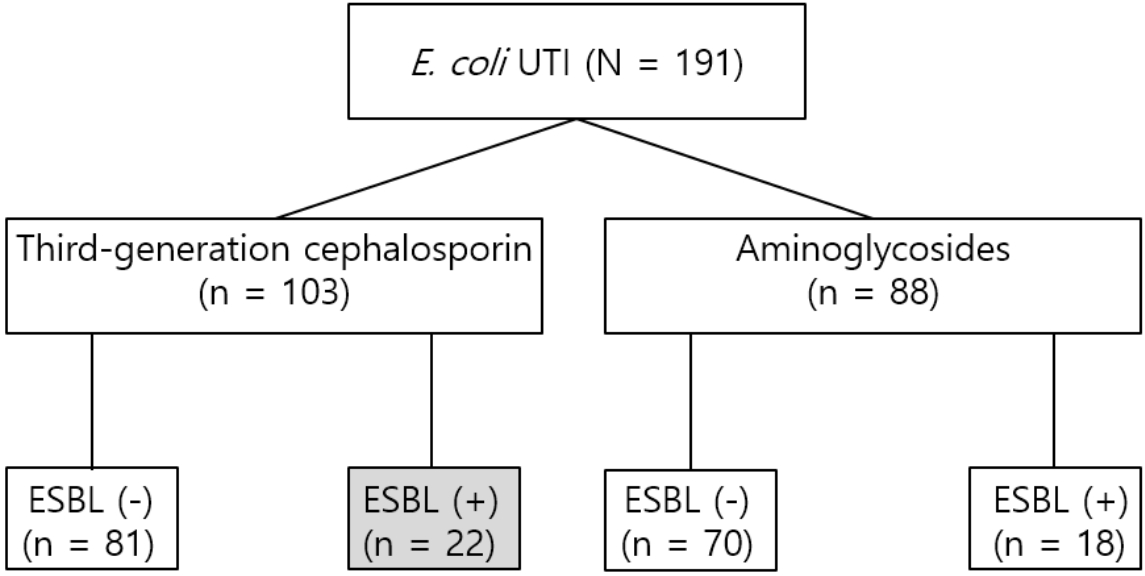
Table 1.Clinical characteristics of the children with Escherichia coli UTI
* See details in Appendix 1, https://doi.org/10.22470/pemj.2020.00045. Table 2.Laboratory findings of the children with Escherichia coli UTI Values are expressed as medians (interquartile ranges). UTI: urinary tract infection, ESBL: extended-spectrum beta-lactamases, WBC: white blood cell, Seg. Neutrophil: segmented neutrophil, ANC: absolute neutrophil count, ALC: absolute lymphocyte count, CRP: C-reactive protein, NTL: neutrophil-to-lymphocyte, NTP: neutrophil-to platelet. Table 3.Outcomes of the children with Escherichia coli UTI
Table 4.Risk factors for the occurrence of extended-spectrum beta-lactamases-positive Escherichia coli UTI
Table 5.Clinical characteristics of the children with recurrent UTI References1. Shaikh N, Morone NE, Bost JE, Farrell MH. Prevalence of urinary tract infection in childhood: a meta-analysis. Pediatr Infect Dis J 2008;27:302–8.
2. Schmidt B, Copp HL. Work-up of pediatric urinary tract infection. Urol Clin North Am 2015;42:519–26.
3. Nuutinen M, Uhari M, Murphy MF, Hey K. Clinical guidelines and hospital discharges of children with acute urinary tract infections. Pediatr Nephrol 1999;13:45–9.
4. Newman TB. The new American Academy of Pediatrics urinary tract infection guideline. Pediatrics 2011;128:572–5.
5. Okarska-Napierała M, Wasilewska A, Kuchar E. Urinary tract infection in children: Diagnosis, treatment, imaging - comparison of current guidelines. J Pediatr Urol 2017;13:567–73.
6. Bryce A, Hay AD, Lane IF, Thornton HV, Wootton M, Costelloe C. Global prevalence of antibiotic resistance in paediatric urinary tract infections caused by Escherichia coli and association with routine use of antibiotics in primary care: systematic review and meta-analysis. BMJ 2016;352:i939.
7. Sefton AM. The impact of resistance on the management of urinary tract infections. Int J Antimicrob Agents 2000;16:489–91.
8. Mazzariol A, Bazaj A, Cornaglia G. Multi-drug-resistant Gram-negative bacteria causing urinary tract infections: a review. J Chemother 2017;29(Suppl 1):2–9.
9. Yoo YM, Park BS, Lee SY, Park KJ, Jung HJ, Pai KS. An epidemiologic study on hosts and pathogens of urinary tract infection in urban children of Korea (2012–2017). Child Kidney Dis 2019;23:29–35.
10. Lee JW, Shin JS, Seo JW, Lee MA, Lee SJ. Incidence and risk factors for extended-spectrum beta-lactamase-producing Escherichia coli in community-acquired childhood urinary tract infection. J Korean Soc Pediatr Nephrol 2004;8:214–22. Korean.
11. Uyar Aksu N, Ekinci Z, Dündar D, Baydemir C. Childhood urinary tract infection caused by extended-spectrum β-lactamase-producing bacteria: Risk factors and empiric therapy. Pediatr Int 2017;59:176–80.
12. Lee H, Han SB, Kim JH, Kang S, Durey A. Risk factors of urinary tract infection caused by extended spectrum β-lactamase-producing Escherichia coli in emergency department. Am J Emerg Med 2018;36:1608–12.
13. Melzer M, Petersen I. Mortality following bacteraemic infection caused by extended spectrum beta-lactamase (ESBL) producing E. coli compared to non-ESBL producing E. coli. J Infect 2007;55:254–9.
14. Ray S, Anand D, Purwar S, Samanta A, Upadhye KV, Gupta P, et al. Association of high mortality with extended-spectrum β-lactamase (ESBL) positive cultures in community acquired infections. J Crit Care 2018;44:255–60.
15. Ramphal R, Ambrose PG. Extended-spectrum β-lactamases and clinical outcomes: current data. Clin Infect Dis 2006;42 Suppl:S164–72.
16. Greenhouse I, Babushkin F, Finn T, Shimoni Z, Aliman M, Ben-Ami R, et al. Long-term outcomes of inappropriate antibiotic therapy for upper urinary tract infections caused by extended-spectrum beta-lactamase-producing Enterobacteriaceae: a retrospective cohort study. Diagn Microbiol Infect Dis 2017;89:222–9.
17. Toubiana J, Timsit S, Ferroni A, Grasseau M, Nassif X, Lortholary O, et al. Community-onset extended-spectrum β-lactamase-producing Enterobacteriaceae invasive infections in children in a university hospital in France. Medicine (Baltimore) 2016;95:e3163.
18. Lukac PJ, Bonomo RA, Logan LK. Extended-spectrum β-lactamase-producing Enterobacteriaceae in children: old foe, emerging threat. Clin Infect Dis 2015;60:1389–97.
19. Rodríguez-Baño J, Pascual Á. Clinical significance of extended-spectrum β-lactamases. Expert Rev Anti Infect Ther 2008;6:671–83.
20. Ahn ST, Kim SW, Kim JW, Park HS, Moon DG, Oh MM. Does urinary tract infection caused by extended-spectrum β-lactamase-producing Escherichia coli show same antibiotic resistance when it recurs? J Infect Chemother 2019;25:498–502.
21. Park C, Kim MS, Kim MK, Yim HE, Yoo KH, Hong YS, et al. Clinical significance of extended spectrum β-lactamase producing Escherichia coli in pediatric patients with febrile urinary tract infection. J Korean Soc Pediatr Nephrol 2012;16:38–45. Korean.
22. Coque TM, Baquero F, Cantón R. Increasing prevalence of ESBL-producing Enterobacteriaceae in Europe. Euro Surveill 2008;13:19044.
23. Polat M, Kara SS. Once-daily intramuscular amikacin for outpatient treatment of lower urinary tract infections caused by extended-spectrum β-lactamase-producing Escherichia coli in children. Infect Drug Resist 2017;10:393–9.
24. Esteve-Palau E, Solande G, Sánchez F, Sorlí L, Montero M, Güerri R, et al. Clinical and economic impact of urinary tract infections caused by ESBL-producing Escherichia coli requiring hospitalization: a matched cohort study. J Infect 2015;71:667–74.
25. Concia E, Cornaglia G, Novelli A. Actual role of older oral antibiotics in the treatment of resistant urinary tract infections (UTIs). J Chemother 2017;29(Suppl 1):1.
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 |
 |