심장성 쇼크
Cardiogenic shock
Article information
Trans Abstract
Cardiogenic shock is an acute circulatory failure due to compromised myocardial contractility associated with congenital heart diseases and cardiomyopathies, such as myocarditis. In this article, the authors present a 3-step overview of cardiogenic shock diagnosis and management to restore tissue oxygen delivery. The first step is early recognition of nonspecific signs of the shock. The second step is medical management, monitoring, and repeated assessment. In addition to conventional parameters, biomarkers may be useful to monitor the shock. The final step is mechanical circulatory support, such as ventricular assist devices, for children with the refractory shock. We also briefly describe the shock in multisystem inflammatory syndrome in children with coronavirus disease 2019.
서 론
쇼크는 전신 조직 관류가 현저히 감소하여 조직 산소공급이 감소하는 병리적 상태이다. 조직 내 산소공급이 부족하면, 정상적 산소대사를 유지할 수 없어 비효율적 무산소대사가 진행된다. 쇼크의 진행에 따라, 조직 내 산소 추출을 이용한 보상 기전의 한계를 초과하여 임상적 악화 및 젖산산증이 발생한다[1]. 쇼크가 지속하면 혈관 반응, 염증, 대사 변화, 세포 반응, 내분비 및 전신 반응과 같은 생리학적 변화 및 불안정성이 나타난다. 부족한 산소공급에 대한 보상의 하나로 특정 기관의 혈류를 감소시켜 뇌, 심장, 신장, 간과 같은 주요 기관의 산소공급을 유지하려고 한다.
쇼크의 원인과 관계없이 쇼크에 대한 환자의 반응 패턴, 병태생리, 임상 증상 및 치료에 대한 반응은 환자의 임상상황 및 생물학적 반응에 따라 다를 수 있다. 일반적으로, 쇼크는 저혈량성, 심장성, 분포(distributive), 폐쇄(obstructive), 패혈 쇼크의 5가지 유형으로 분류할 수 있다. 소아에서는 주로, 선천심장병 또는 급성심근염을 포함한 심근병증 환자에서 심장성 쇼크가 발생한다[2].
Coronavirus disease 2019 (COVID-19) 대유행(범유행) 시대에 중증급성호흡기증후군 코로나바이러스2(severe acute respiratory syndrome-coronavirus 2, SARS-CoV-2)에 의한 소아 다기관염증증후군(multisystem inflammatory syndrome in children, MIS-C) 환자에서 심혈관질환이 보고되고 있다[3]. MIS-C 환자는 열, 위장관 및 호흡계 증상, 쇼크를 보일 수 있으며, 심실 기능장애, 관상동맥 확장 또는 동맥류, 부정맥 등이 높은 빈도로 보고되고 있다[4].
따라서, 본 종설에서는 소아 심장성 쇼크의 임상증상, 진단 및 치료를 고찰하고, 치료 원칙 및 새로운 치료법인 심실보조장치(ventricular assist device, VAD)에 대해 시의적절하게 언급하고자 한다.
본 론
1. 역학
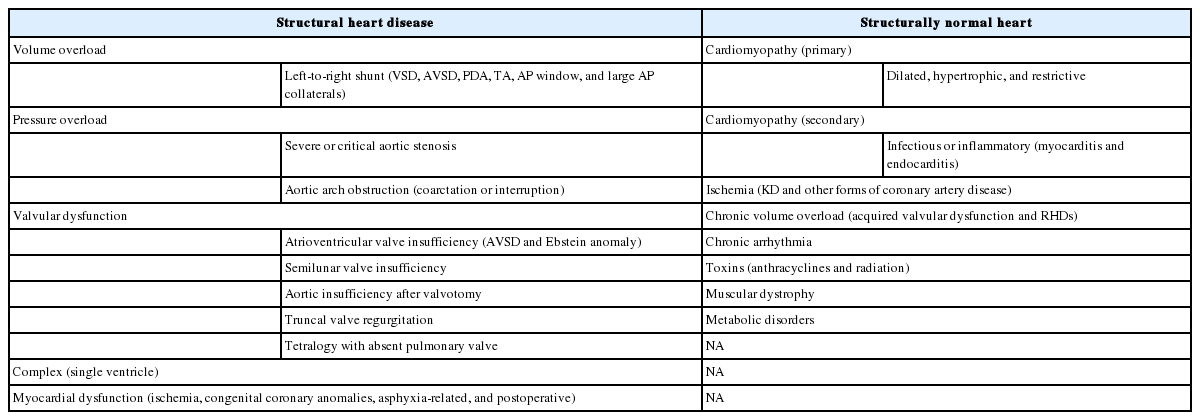
소아에서 역학에 대한 자료는 제한적이다. 넬슨 소아과학 21판에 따르면, 선진국에서 성인을 포함한 입원 환자의 약 2%에서 쇼크가 발생하며, 사망률은 원인과 임상 상황에 따라 다르다[5]. 사망은 대개 급성 저혈압 쇼크 단계보다 관련 합병증 및 다발장기부전(multi-organ failure)에 기인한다[6]. 임상 보고에 따르면, 소아 쇼크의 흔한 원인은 심한 설사로 인한 저혈량, 외상성 출혈, 패혈증 등이다. 심장성 쇼크는 소아응급실에서 진단된 쇼크의 5%-17%를 차지하고[7,8], 그 원인은 Table 1에 나열했다[9,10].
심장성 쇼크는 심장질환 및 외상(예: 선천심장병, 심근염 및 심근병증, 심근 타박상, 심근 허혈, 부정맥)에 의한 펌프 부전(pump failure)으로 인해 발생한다. 또한 전통적 원인 외에도 COVID-19와 같은 감염병도 이를 유발할 수 있다.
COVID-19 대유행 시기에 MIS-C가 유럽, 아메리카, 아시아에서 보고되고 있다[11,12]. 이 환자 중 일부는 쇼크 및 다발장기부전으로 중환자실 치료가 필요하거나, 가와사키병 또는 가와사키병 쇼크증후군(Kawasaki disease shock syndrome)과 유사한 임상증상을 보였다[4,13].
2. 병태생리
심장성 쇼크는 심장의 펌프 부전, 즉 수축 기능 및 심박출량 감소에 의해 발생한다. 조직 산소공급을 결정하는 요소에는 혈류량, 혈류량과 대사 요구량 사이의 균형, 산소함유량(oxygen content)이 포함된다. 감소한 혈류를 보상하기 위한 생리학적 변수에는 일회박출량 및 심박수가 포함되고, 일회박출량은 전부하, 심근수축력, 후부하가 결정한다.
세포 저산소증(cellular hypoxia)은 조직 관류저하, 산소공급 감소, 산소 소비 증가 또는 부적절한 사용으로 인해 발생하고, 세포막 이온펌프 기능장애, 세포 내 부종, 세포액의 세포 외 공간 누출 및 세포 내 pH의 부적절한 조절을 유발한다[14,15]. 이 상태가 지속하면 생화학적 변화가 전신으로 진행되어 대사산증 및 혈관내피 기능장애를 유발할 뿐만 아니라, 염증 및 항염증 연쇄반응으로 이어진다[16]. 이 일련의 과정이 복합적으로 작용하여, 조직 관류가 더 감소한다[16,17].
쇼크의 초기 단계에는 다양한 보상 기전이 혈압, 조직관류, 산소공급을 유지한다. 심혈관계 효과에는 교감신경계 활성화 및 신경호르몬 조절을 통한 심박수, 심박출량, 혈관긴장도 증가가 있다. 호흡 보상은 대사산증에 대한 반응으로, 이산화탄소 배출 촉진과 부족한 조직 관류로 인한 이산화탄소 생산 증가와 연관된다. 정상 체내 pH를 유지하기 위해, 수소이온의 신장 배설 및 중탄산염 저류가 증가한다. 레닌-안지오텐신-알도스테론계 및 심방나트륨뇨배설인자 축(atrial natriuretic factor axes), 코티솔 및 카테콜아민 합성 및 분비, 항이뇨호르몬 분비를 통한 나트륨 조절을 통해 혈관 내 용적을 유지하려 한다. 이러한 보상 기전에도 불구하고, 기저의 쇼크 및 신체의 반응으로 인해 혈관내피 손상으로 인해 혈관내액(intravascular fluid)이 세포 외 공간으로 누출된다. 쇼크의 다른 중요한 초기 병태생리는 일회박출량에 미치는 영향이다. 모든 형태의 쇼크에서 심박수, 전부하, 심근수축력, 후부하의 변화가 개별적으로, 또는 조합되어, 일회박출량에 영향을 준다. 쇼크에 대한 주요 보상 기전은 체액 손실 및 전부하 감소에 대해 심박수 및 말초혈관저항을 증가시키는 것으로, 이는 심박출량 및 전신 혈압을 유지하기 위한 초기 기전이다. 만약 적절한 체액 보충이 없다면, 저혈압 및 조직 허혈이 발생하고 임상적으로 악화한다. 이 상태에서 추가로 삼투압이 낮으면, 내피 손상 및 모세혈관 누출로 인해 더 많은 체액 손실 및 쇼크 악화가 발생한다. 쇼크의 보상 기전에 의해 빈맥, 호흡곤란, 안절부절, 발한, 대사산증, 저혈압, 핍뇨, 차고 축축한 피부를 포함한 장기부전의 임상소견이 나타난다. 장기부전의 임상증상은 일반적으로 심각한 병태생리학적 변화에 의해 발생한다. 심장성 쇼크에서는 심장박출지수가 상당히 감소한 후, 임상증상이 발생한다[2,18].
3. 심부전 및 심장성 쇼크의 진단 및 치료 원칙
1) 쇼크의 인지
심장성 쇼크를 치료하려면 조기에 인지하는 것이 중요하다. 여기에 유용한 비특이적 증상으로, 초기에 빈호흡을 동반하지 않은 빈맥, 진행된 상태에서의 핍뇨, 말초 관류저하, 호흡 곤란 또는 부전, 의식상태 변화, 저혈압을 들 수 있다(Table 2)[19]. 흔히 임상의가 저혈압을 근거로 쇼크여부를 판단해야 한다고 오해한다. 하지만, 저혈압은 초기에 혈압 및 말초 관류를 보존하려는 복잡한 보상 기전으로 인해 나타나지 않는 경우가 많으므로, 진단 기준에 포함되지 않는다. 저혈압은 보상되지 않은 쇼크(decompensated shock)를 시사하며 사망과 연관된다.
2) 쇼크의 분류
심부전과 심장성 쇼크는 정맥울혈(충만압 증가로 인한) 유무와 관류저하(심박출량 또는 심근수축력 감소) 유무에 따라 분류할 수 있다[20]. 정맥 울혈이 있으면‘습성(wet)’, 없으면‘건성(dry)’으로, 관류저하가 있으면‘차가운(cold)’, 없으면‘따뜻한(warm)’으로 각각 분류한다. 습성 쇼크는 폐부종, 간비대, 복수, 경정맥 팽창, S3 말굽심음, 수포음을 보일 수 있다. 차가운 쇼크는 차가운 사지, 약하고 좁은 맥압, 모세혈관충전시간 지연, 의식 변화, 저혈압을 보일 수 있다[2,21].
3) 쇼크의 진단
쇼크의 진단은 주요 임상증상인 빈맥, 조직 관류저하, 핍뇨 및 의식 변화 정도를 고려하여 이뤄진다. 저혈압 또는 조직 관류저하 및 고젖산혈증(hyperlactatemia) 외에도, 심박출량, 말초혈관저항, 혼합정맥혈 산소포화도, 활력징후 측정이 진단에 유용하다[22]. 혈압이 정상이라도 보상 빈맥 및 말초혈관 수축이 있으면 쇼크를 의심해야 한다. 임상증상이 쇼크의 원인 및 단계에 따라 다양하므로, 한 가지 변수만으로 진단하거나 치료 방침을 결정하기 어렵다. 다만, 저혈압, 빈맥, 핍뇨, 의식상태 변화, 빈호흡, 차고 축축한 피부, 대사산증, 고젖산혈증 등이 있다면, 쇼크를 강하게 의심해야 한다[1].
4) 쇼크의 치료 및 감시
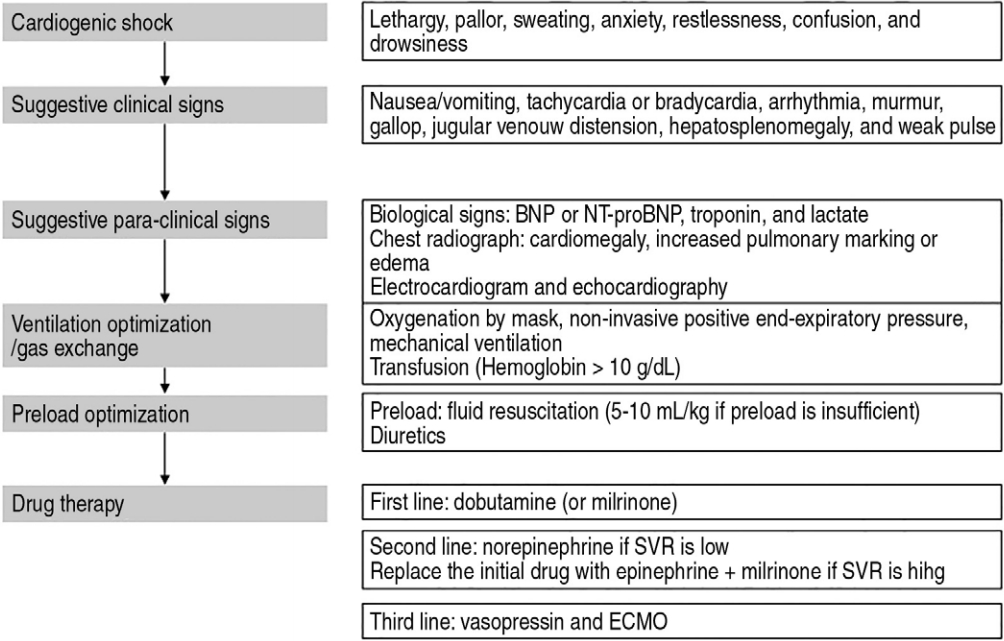
치료 목표는 정상 심박수 및 관류압(perfusion pressure) 회복, 기저 질환 호전, 주요 장기의 지속적 허혈 예방이다[5]. 정상 상태라면 교감신경계 항진을 통해 심근수축력 및 심박수를 늘림으로써 심박출량을 증가시켜 허혈을 개선할 수 있다[23]. 하지만 심근수축력이 감소한 상황에서는, 심박수를 늘리거나, Frank-Starling 법칙을 통해 심실충만압(ventricular filling pressure, 전부하) 증가 또는 말초혈관저항(후부하) 감소를 통해 심박출량을 개선할 수 있다[24,25]. 최적의 심실충만압은 환기 지원(ventilator support) 및 복강 내 압력을 포함한 심장 외 요인에 따라 달라진다. 특히, 심장수술 후 또는 제한심근병증, 비대심근병증 환자에서 적절한 심실충만압이 일반 환자와 다를 수 있다. 심장성 쇼크 환자에서 수액요법은 임상적으로 전부하 부족을 확인 후 투여해야 하며, 이 과정에 심초음파검사가 유용하다[2]. 주의 깊은 수액요법에도 심박출량이 개선되지 않으면, 비정상적 심근수축력 또는 비정상적으로 높은 후부하가 낮은 심박출량의 원인일 수 있다. 심박수 증가를 통해 심박출량을 개선하려고 시도할 수 있다. 그러나 지나친 심박수 증가는 심실충만을 위한 확장기를 단축함으로써, 오히려 심박출량이 감소하고 심근 산소요구량이 늘어나 심근의 산소 요구 및 공급 균형에 부정적 결과를 초래할 수 있으므로 주의해야 한다.
심장성 쇼크 환자는 초기부터 감시를 지속해야 한다. 심박수, 수축기 및 평균 혈압, 소변량, 중심정맥압, 중심 및 혼합 정맥혈 산소포화도, 젖산, 심박출량 등이 감시 대상이다[1].
쇼크의 진단, 감시, 예후 예측을 위한 생물표지자 개발에 많은 관심이 있었다. 좋은 표지자는 객관적으로 환자 상태를 측정하고, 치료 반응을 감시하며, 예후를 예측할 수 있어야 한다[26]. 심부전 및 심장성 쇼크를 위한 주요 표지자로, 혈중 젖산, 심근효소 및 뇌나트륨배설펩타이드가 알려졌다. 젖산은 전체 조직산소결핍증(histanoxia) 및 무산소대사를 측정하는 지표로, 사망 예측에 유용하고 2-3 mmol/L를 치료의 목표로 한다[27,28]. 심근효소 중에서 크레아틴인산화효소MB동종효소는 도움이 되지 않지만, 트로포닌은 심근 손상 정도 및 치료 반응 평가에 유용하다고 알려졌다[29]. 뇌나트륨배설펩타이드는 돼지의 뇌에서 처음으로 확인한 표지자로, 심방 및 심실 근육에서 합성된다. 좌심실 확장말기압력(end-diastolic pressure) 증가 및 심장 벽 스트레스 증가로 인한 심근 늘임(myocardial stretching)은 뇌나트륨배설펩타이드 유전자의 전사를 촉진하는 것으로 알려졌다[30]. 소아 심장성 쇼크에서 이 펩타이드의 예후 예측 성적은 아직 입증되지 않았지만[31], 심근병증이 있던 환자에서는 심장기능 평가를 위한 효과가 입증되어, 이 목적으로 소아 심장성 쇼크 환자에서 사용하고 있다[2].
쇼크의 원인에 대한 치료가 시작되고 저산소증 및 대사산증이 교정되면서 일반적으로 심근수축력이 향상되지만, 수축력 감소가 지속하면 수축촉진약(inotropic drug) 투여가 필요하다. 대표적 수축촉진약인 베타아드레날린작용제(예: dopamine, epinephrine, dobutamine)는 수축력 및 심박수를 늘려 궁극적으로 심박출량을 증가시킨다(Fig. 1). 그러나, 이 중 일부는 알파아드레날린작용제 효과를 통해 후부하를 증가시키므로, 두 효과의 균형을 신중히 고려하여 사용한다[23]. 심장성 쇼크 환자에서 후부하가 현저히 크고 말초 관류가 불량한 경우가 많으므로, 후부하 증가가 지속하고 수축촉진약 단독 투여가 조직 관류를 개선하지 못하면 베타아드레날린작용제와 함께 nitroprusside 또는 milrinone 등으로 후부하를 낮춰야 할 수 있다. 특히, milrinone은 심근수축력을 늘리고 베타아드레날린작용제와의 상승효과를 통해 심근 내 고리일인산아데노신 농도를 높인다[19,32].
주기적 쇼크 환자 평가와 상태에 따른 대응은 치료에 필수적이다(Fig. 2). 심장 관련 약 외에도 산소함유량을 개선하고(예: 빈혈 환자의 수혈), 산소 요구량을 줄이는(예:기관내삽관, 기계환기, 진정) 치료법이 도움이 될 수 있다. 심장성 쇼크가 약물요법에 빠르게 반응하지 않으면, 기계적 순환보조 장치(mechanical circulatory support, MCS)를 고려한다[33].
5) MCS
MCS의 목표는 적절한 전신 관류 유지, 신장 및 간 기능안정화 및 회복, 심근 부하 감소, 심장성 쇼크 안정화 및 심한 폐부종 환자를 위한 호흡 지원 등이다. 이 목표를 설명하는 용어로,‘ bridge-to-recovery’,‘ bridge-to-decision’,‘bridge-to-bridge’등이 있다. MCS는 일반적으로 최대의 약물요법(예: 수축촉진약, 후부하 감소제)에도 호전되지 않는 쇼크 환자에게 적용하지만, ‘최대’의 의미가 기관 또는 의사의 경험에 따라 다를 수 있어 보편적 적응증을 만들기 어렵다. MCS가 심실 부하 및 산소요구량에 미치는 유익한 효과 때문에 적극 약물요법에 반응하지 않는 심장성 쇼크 시, 이 장치를 조기 적용하면 대부분의 상황에서 더 나은 결과를 얻을 수 있다는 보고가 있다[34]. 원활한 MCS 적용을 위해, 대상자에게 널리 사용하는 Interagency Registry for Mechanically Assisted Circulatory Support profile로 중증도를 분류할 수 있다(profile 1이“critical cardiogenic shock”)[35].
역사적으로 보면, 체외막산소공급(extracorporeal membrane oxygenation, ECMO)은 소아 심장성 쇼크 및 불응 심부전의 유일한 MCS 수단이었다. 하지만 소아에서도 VAD의 단기 사용이 가능해지면서, ECMO는 폐기능 지원이 필요한 소아 환자에 주로 시행하고 있다. ECMO는 용적과부하 및 좌심실 확장말기압력 상승으로 인한 폐기능 장애를 동반하는 소아 환자의 심폐기능을 지원할 수 있는데, 최근 소아 ECMO 이용 방침은 말초 삽입관(cannula) 사용을 병행하며, 순환보조를 더 쉽게 하려고 하는 것이다. 또한, 소아용 삽입관 개발로 ECMO의 다양한 관삽입(cannulation) 전략이 소아 환자에게 가능해지면서 유연하게 이용되고 있다. 중심 관삽입 전략은 대동맥 및 우심방을 이용하며, 대개 심장수술 후, 큰 동맥관개존증 또는 공격적 심실 감압이 필요한 환자에게 사용한다. 이 전략의 장점은 빠른 효과, 높은 정맥 배액, 좌심방 배액과 좌심실 관삽입이 쉬운 점이다. 하지만, 중앙 흉골절개 자체와 출혈 및 감염 위험이 중심 관삽입의 장애 요인으로 작용할 수 있다. 소아 환자는 말초혈관 크기가 작으므로 경동맥 및 내경정맥을 통한 목 삽입관이 말초 관삽입 전략을 위한 가장 일반적인 방법이다. 그러나, 말초 관삽입은 종종 작은 삽입관 크기로 인해 전체 흐름을 달성하는 효과가 제한적일 수 있으며, 치료 기간에 경동맥 원위 폐쇄 가능성이 있어 논란의 여지가 있다[36]. 연장아에서 대퇴 동맥 및 정맥이 가장 흔한 말초 관삽입 부위이다. 하지만, 이 혈관이 심장도관삽입 및 심혈관조영에 반복 사용되는 복잡한 선천심장병 환자에서는 적용할 수 없는 단점이 있고, 동맥보다 큰 삽입관을 넣은 후 사지 말단의 허혈 위험도 보고된다[37].
급성 좌심실 기능장애를 보조하기 위해 veno-arterial ECMO를 사용하는 것은 심실 부하를 줄이지 못할 수 있다. 좌심실 감압이 이뤄지지 않으면 좌심실 압력이 증가한 상태를 유지한다. 심실 부하를 줄임으로써 심근 회복을 꾀하기 위해, 심부전 또는 전격 심근염 환자에서 좌심실 환기(left ventricular venting)를 수행할 수 있다[38]. 좌심실 환기와 달리, 좌심방 환기(left atrial venting)는 좌심방 부하를 개선함으로써 폐부종 호전에 더 효과적일 수 있다[34]. ECMO 요법의 시작은 최적의 환기 삽입관 배치라고 할 수 있다.
삽입관을 배치할 때 지혈에 주의해야 한다. 출혈 시 수혈하거나 항응고제 용량을 줄이면, 종종 조기 산소공급기(oxygenator) 기능장애 및 삽입관 혈전증 등 유해한 연쇄반응을 초래할 수 있다. ECMO가 소아에서 단기 MCS의 주된 역할을 수행해 왔지만, 최근 VAD 사용이 증가하고 있다. 이는 소아에게 적용 가능한 작은 크기의 펌프 발달, 산소공급기를 사용하지 않는 장점, 항응고제 요법의 발전으로 가능해졌다. 그러므로, 폐부종으로 인한 호흡부전이 없고 VAD의 금기에 해당하지 않는 환자에서 VAD는 ECMO의 대안이 될 수 있다. 산소공급기 없이 VAD에서 삽입관 배치는 심방 또는 심실에 직접 혈류를 유입해야 하므로 더 제한적인데, 전격 심근염 환자에게는 주로 좌심방 관삽입을 권장하고, 단기 VAD 사용에는 주로 원심 펌프(centrifugal pump)를 사용한다.
심장이식은 말기 심부전의 최종 치료법이다. 그러나, 소아(특히 체중이 작은)에서 적은 공여자 수와 면역부적합으로 이식 대기 중 사망률이 높고, 특히 심장성 쇼크가 발생한 선천심장병 또는 심근염 환자가 더 위험하다[39].
대표적인 소아 VAD는 작은 영아에서도 사용되고 있는 Berlin Heart EXCOR® (Berlin Heart GmbH, Berlin, Germany)이다. 이는 심장이식 전 장기(長期) VAD로 사용되며, 공기압을 이용한 박동성(pulsatile) 심장기능 보조장치로서 신생아 및 영아 대상으로 유일하게 미국 식품 의약국 허가를 받은 제품이다. ECMO보다 합병증이 적고, 이식 전 재활치료를 통해 전신 상태 호전을 기대할 수 있다.
최근 새롭게 성인 대상으로 개발된 지속형(continuous-flow) VAD는 크기가 작아 소아∙청소년 대상으로 사용할 수 있다. 이 장치는 박동성 VAD보다 뇌혈관 합병증 및 기계 이상의 발생률이 낮다고 알려졌다[40,41]. 하지만 여전히 성인용 제품을 작은 소아에 적용하기는 어려워, 이 환자군에도 적용 가능한 지속형 VAD 개발이 기대된다. 2018년, 한국에서도 Berlin Heart EXCOR®가 건강보험 급여 항목으로 승인되어 일부 병원에서 소아를 대상으로 사용 중이다. 2020년, 10개월 확장심근병증 환자가 Berlin Heart EXCOR® 적용 24일 후 이식에 성공한 첫 한국 증례가 보고됐다[42]. 새로운 VAD 및 삽입관은 약물요법에 반응하지 않는 심장성 쇼크 환자의 예후 개선에 도움이 될 것이다.
4. COVID-19 연관 MIS-C에 의한 심장성 쇼크
SARS-CoV-2는 안지오텐신전환효소-2 수용체에 결합하여 세포 안으로 진입하는데, 이 효소는 레닌-안지오텐신-알도스테론계의 핵심 요소로, 심혈관질환의 병태생리에 중요한 역할을 한다. 또한, 이 감염에 의한 심혈관질환 악화는 레닌-안지오텐신-알도스테론계의 조절 장애 및 고혈압 또는 죽상경화증과 같은 동반 질환에 기인한다[43,44]. 인터루킨-6, -17 및 기타 사이토카인의 방출 조절 장애와 T세포 활성화로 인한 사이토카인 폭풍은 COVID-19에서 심혈관질환을 유발할 수 있다. 이러한 면역계 활성화는 죽상경화판의 불안정을 초래하여 급성 관상동맥질환이 발생할 수 있다[44,45].
COVID-19 대유행 시대에 열, 위장관 증상, 발진, 쇼크를 보이는 MIS-C 증례가 보고되고 있다[11]. 진단 기준은 가와사키병과 유사하다[46-48]. MIS-C 환자의 47%-80% 및 4%-29%에서 각각 승압제 및 ECMO가 필요했다[11,49-51]. 현재 추정하고 있는 병태생리는, 발생 시점에 환자에서 SARS-CoV-2에 대한 항체가 확인되는 점에서 이 바이러스에 대한 면역 이상반응이다. 가와사키병에서 알려진 것처럼, MIS-C의 면역복합체가 혈관 및 심근 손상에 관여하고, 이로 인해 관상동맥 확장 및 심실기능 저하를 유발하는 것으로 추정하고 있다[52]. 대부분 중증 경과를 보이며, 중환자실 치료, 면역조절, 승압제 및 항응고제 투여가 필요하다[3]. 미국, 영국, 프랑스, 스위스의 MIS-C 치료 경험을 종합한 결과(n = 378), 사망률은 1.9% (7명)였고, 치료법별로 정맥내면역글로불린이 73.8% (279명), 스테로이드가 53.7% (203명), 수축촉진약이 54.5% (206명)에서 필요했으며[53], ECMO 시행 빈도는 4%-29%로 프랑스에서 가장 높았다[49].
결 론
본 종설에서는 소아 심장성 쇼크의 인지, 진단, 치료 및 감시에 대해 전반적으로 고찰하고, 치료 방침을 제시했다(Fig. 2). 새롭게 적용되는 VAD가 불응 쇼크의 치료에 도움이 되고 있다. 또한, COVID-19 대유행 시대에 MIS-C에 의한 심장성 쇼크 발생에 대해 대비해야 한다.
Notes
이해관계
모든 저자는 이 논문과 관련된 이해 관계가 없음.
재정지원
모든 저자는 이 논문과 관련된 재정지원을 받지 않았음.