일산화탄소 중독 소아의 임상적 특성: 단일 기관 연구
Clinical features of children with carbon monoxide intoxication: a single center study
Article information
Trans Abstract
Purpose
To investigate the effect of lifestyle changes on patterns of carbon monoxide (CO) exposure and the association between neurologic symptoms and outcomes in Korean children with CO intoxication.
Methods
We reviewed the medical records of patients (< 18 years) with CO intoxication who visited the emergency department of Pusan National University Hospital between February 2012 and January 2020. We collected clinical findings, including age and sex, transfer from other hospitals, source, time and duration of exposure, manifestations with neurologic symptoms (syncope, seizure, and altered mental status), intensive care unit hospitalization, hospital length of stay, implementation of hyperbaric oxygen therapy, and findings of neuroimaging. These variables were compared between children with and without neurologic symptoms. In addition, levels of carboxyhemoglobin and lactate were compared between patients with and without specific manifestations.
Results
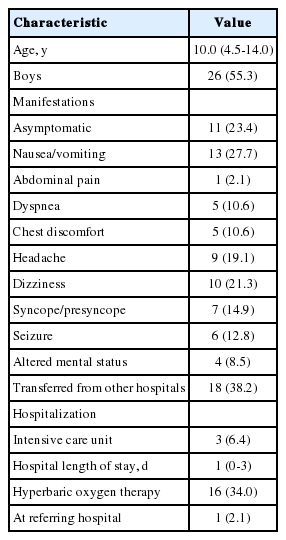
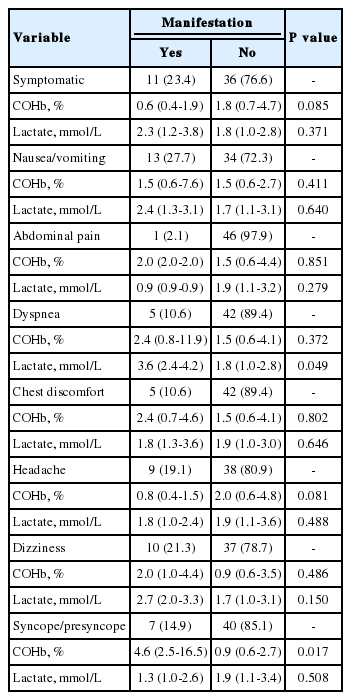
The enrolled 47 patients’ median age was 10 years (interquartile range, 4.5-14.0). The most common source of exposure was fire (46.8%), followed by camping (23.4%). The most common times of exposure were night (44.7%) and winter (44.7%). The patients with neurologic symptoms (14 [29.8%]) showed longer duration of exposure and hospital length of stay (P < 0.001 and P = 0.007, respectively). Of the 14 patients, 2 were hospitalized to the intensive care unit without an in-hospital mortality. A significant association was found between dyspnea and lactate level (P = 0.049), also between syncope or presyncope and carboxy hemoglobin level (P = 0.017).
Conclusion
CO intoxication in Korean children is most often caused by fire and camping, and at night and in winter. There is a correlation between neurologic symptoms and duration of exposure to CO.
서 론
일산화탄소 중독은 중요한 사망 원인으로, 응급실에서 감별해야 한다[1-6]. 그러나 소아환자(환자)의 일산화탄소 중독은 비특이적 임상증상으로 인해 늦게 발견할 수 있어 주의해야 한다[3,6-12]. 지금까지 한국 일산화탄소 중독은 대개 연탄가스에 기인했고, 이는 1960년대에 난방 및 취사를 위해 연탄을 많이 사용했기 때문이다[13,14]. 그러나 생활환경의 변화로 연탄가스 노출이 감소한 반면, 최근에는 자살시도로 인한 일산화탄소 중독 사고가 청소년에서도 보고되고 있는 상황이다[5,15-17]. 따라서, 최근 한국 소아 일산화탄소 중독에 대한 재평가가 필요하다. 본 저자는 생활환경 변화가 소아 일산화탄소 중독에 미친 영향 및 신경학적 증상 유무에 따른 예후의 차이를 분석하고자 본 연구를 수행했다.
대상과 방법
1. 연구 대상
2012년 2월부터 2020년 1월까지 급성(< 24시간) 일산화탄소 중독으로 본원 응급실을 방문한 18세 미만의 환자를 대상으로 했다. 본 연구는 부산대학교병원 임상연구심의위원회 승인을 얻은 후 시행했다(IRB no. H-2002-025-088).
2. 연구 방법
의무기록을 바탕으로 환자의 나이, 성별, 임상증상, 전원, 중환자실 입원, 입원 기간, 고압산소요법, 혈액검사, 뇌영상 결과를 수집했다. 일산화탄소 중독 원인, 노출 시기를 시간대(낮 06-14시, 저녁 14-22시, 밤 22시-06시) 및 계절(봄 3-5월, 여름 6-8월, 가을 9-11월, 겨울 12-2월)별로 조사했다. 혈액검사 항목 중 일산화탄소헤모글로빈 및 젖산 농도를 기록했다. 특정 증상 유무에 따른 일산화탄소헤모글로빈 및 젖산 농도를 비교하고, 신경학적 증상(실신, 발작, 기타 의식변화)에 따른 나이, 성별, 노출 시간, 중환자실 입원, 입원 기간, 고압산소요법, 일산화탄소헤모글로빈 및 젖산 농도의 차이, 영상검사 결과를 분석했다. 고압산소요법은 방문 후 첫 6시간 이내에 시작하여 2기압으로 6-12시간 간격으로 총 3회 이상 시행하고, 이 요법의 대상이 되지 않는 환자에게는 100% 산소를 투여했다.
3. 분석 방법
연속형 변수는 정규분포 여부에 따라 평균 및 표준편차 또는 중앙값 및 사분위수 범위로 기술했고, 범주형 변수는 환자 수와 백분율로 기술했다. 임상증상에 따른 환자군의 차이를 확인하기 위해 연속형 변수는 Mann-Whitney U test로, 범주형 변수는 Fisher exact test로 분석했다. 통계 프로그램으로 SPSS Statistics for Windows ver. 23 (SPSS Inc., Armonk, NY)을 이용했고, 통계적 유의수준은 P < 0.05로 정의했다.
결 과
연구 기간에 본원 응급실을 방문한 급성 일산화탄소 중독 환자는 총 47명이었다. 나이의 중앙값은 10세(사분위수 범위, 4.5-14.0)이었고 남자가 26명(55.3%)이었다. 여러 증상을 동시에 호소하는 환자가 많았는데, 구토 및 구역이 가장 흔했고(13명[27.7%]) 무증상이 뒤를 이었다. 18명(38.2%)이 외부 병원에서 전원 됐고, 3명(6.4%)은 중환자실에 입원했다. 47명 모두 산소요법을 받았고, 이 중 16명(34.0%)이 고압산소요법을 받았다. 고압산소요법 받은 환자 중 1명은 외부에서 고압산소요법 시행 후 본원을 방문했다(Table 1).
중독 원인은 화재 22명(46.8%), 캠핑 11명(23.4%), 연탄 및 가스 노출 10명(21.3%), 찜질방 4명(8.5%) 순이었다. 이 중 자살 의도와 연관된 중독 환자는 5명(10.6%)으로, 모두 청소년(나이 중앙값, 17세[사분위수 범위, 16-17])이었다. 노출 시간의 중앙값은 25분(사분위수 범위, 6.3-217.5)이었고, 노출 시기는 시간대 및 계절별로 각각 밤(44.7%)과 겨울(44.7%)에 가장 흔했다(Table 2).
임상증상별 일산화탄소헤모글로빈 및 젖산 농도는 호흡곤란 환자의 젖산 농도(P = 0.049)와 실신 증상이 있는 환자의 일산화탄소헤모글로빈 농도(P = 0.017)는 유의하게 높았다(Table 3).
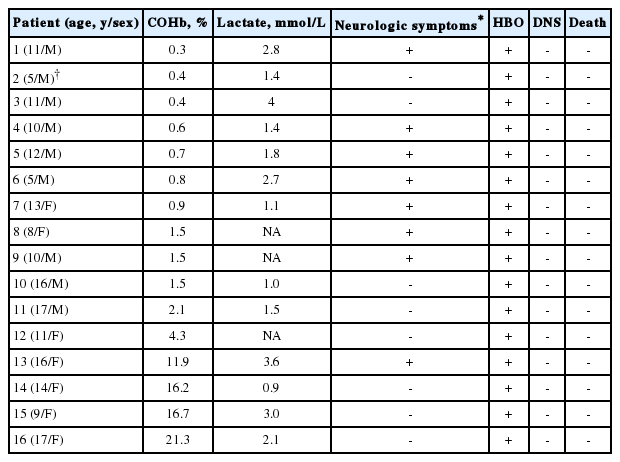
신경학적 증상을 보인 환자는 총 14명(29.8%), 나이의 중앙값은 9.5세(사분위수 범위, 5.0-15.0)이었고, 남자가 9명이었다. 14명 중 2명은 중환자실에 입원했고 8명이 고압산소요법을 받았으나, 신경학적 증상에 따른 고압산소요법 빈도에는 유의한 차이가 없었다. 뇌영상을 시행한 13명 중, 2명에서 각각 담창구 병소 및 혈류역학뇌경색증을 확인했다. 신경학적 증상을 보인 환자에서 노출 시간 및 입원 기간이 유의하게 길었다(Table 4). 신경학적 증상이 있는 8명을 포함하며 총 16명이 고압산소요법을 받았고, 지연성 신경학적 합병증(delayed neuropsychiatric sequelae)이 발생하거나 사망한 환자는 없었다(Table 5).
고 찰
본 연구는 소아 일산화탄소 중독의 최근 데이터를 분석하여 제공했다는 것에 의의가 있다. 일산화탄소 노출 원인으로 화재 및 캠핑이 가장 흔한 점은 생활환경 변화를 반영한 것이다. 신경학적 증상과 긴 노출 시간 및 입원 기간이 유의한 연관이 있음을 확인했다. 이 결과는 과거 한국 일산화탄소 노출 원인이 연탄 사용이었다는 것과 큰 차이를 보인다[13,14]. Kim 등[18]도 최근 생활환경의 변화로 캠핑이 증가하면서, 이에 따른 일산화탄소 중독의 증가를 보고했다.
본 연구에서 연탄 및 가스 노출로 인한 일산화탄소 중독중 자살 의도가 절반을 차지했고, 중독은 겨울 및 밤에 가장 많이 발생했다. 이 시기에 실내 난방, 찜질방 등의 이용률이 높고, 자살시도 또한 주로 발생하는 것과 연관이 있는 것으로 추정한다. Lee 등[19]에 따르면, 한국 10대 청소년과 성인을 포함한 일산화탄소 이용 자살 연구에서 사망 환자가 2014년 하루 평균 5명이었으며 2013년 이후 3대 자살 사망 원인에 포함된다. 같은 연구에서 일산화탄소 이용 자살은 30-50대에서 가장 흔하지만, 10대에서도 일산화탄소를 이용한 자살률이 증가하고 있음을 보고했다. 또한, 봄과 겨울, 10-12시 및 17-23시에 상기 자살 빈도가 높았다고 보고했다[19]. 본 연구에서 자살시도 환자는 모두 청소년이었다는 점이 중요하다. 2007년 이후 자살이 청소년 사망 원인 1위이므로, 사회적 관심과 지원이 필요하다[17].
본 연구에서 일산화탄소 중독 환자 나이의 중앙값(10세) 및 주요 증상은 다른 연구 결과와 유사했다[9,20]. 또한 신경학적 증상 환자는 노출 시간과 입원 기간이 유의하게 길었다는 점은 신경학적 증상 환자에서 일산화탄소헤모글로빈 농도와 입원 기간이 유의하게 높거나 길었다는 보고와 일치한다[6]. 급성기에 일산화탄소헤모글로빈 농도가 높으면, 저산소증으로 인한 뇌 및 심장 손상이 발생하여 신경학적 후유증 또는 사망을 초래할 수 있으므로 응급실에서 신경학적 증상에 대한 빠른 평가 및 처치가 필요하다[21].
본 연구에서 호흡곤란이 있는 환자의 젖산 농도와 실신 증상이 있는 환자의 일산화탄소헤모글로빈 농도는 유의하게 높았다. Sethuraman 등[20]은 평균 나이 8.9세, 일산화탄소헤모글로빈 농도 중앙값 14.3%(사분위수 범위, 3.4-30.1)로 농도와 임상증상의 유의한 연관은 없으나 농도가 25%를 초과하면 신경학적 증상이 흔하게 발생할 수 있다고 보고했다. 또한 Hampson과 Hauff [11]는 환자 228명과 성인환자(18세 이상) 1,179명 대상 연구에서 의식변화 환자의 일산화탄소헤모글로빈 농도가 통계적으로 유의하게 높았다고 보고했다. Damlapinar 등[9]은 젖산 농도가 발작과 의식변화 환자에서 유의하게 높았다고 보고했다. 따라서, 일산화탄소헤모글로빈 농도와 젖산 농도는 심한 중독을 시사한다.
고압산소요법을 받은 환자 중 추적관찰에서 지연성 신경학적 합병증이 발생한 환자는 없었다. 본 연구에서 신경학적 증상을 보인 환자에서 노출 시간이 유의하게 길었다. 이는 Kim 등[14]의 연구에서 노출 시간이 길수록 지연성 신경학적 합병증 발생빈도가 증가한 점과 Pepe 등[22]의 연구에서 긴 노출 시간, 발작, 낮은 글래스고혼수척도 등이 지연성 신경학적 합병증 발생에 영향을 미친다고 보고한 점과 일맥상통한다. 그러므로 일산화탄소 중독 환자에서 긴 노출 시간이 장기적 신경학적 예후에 영향을 미칠 수 있음을 고려해야 한다.
본 연구의 제한점은 다음과 같다. 단일기관 후향적 연구로 표본이 작고, 일부 자료가 의무기록에서 누락됐을 수 있다. 본 연구에서 호흡곤란은 저산소증 및 대사산증을 보상하기 위한 빈호흡에 주로 기인했다고 가정했다. 그러나, 호흡곤란은 화재 시 다양한 유독가스에 의한 비특이적인 호흡계∙중추신경계∙심혈관계 증상과 감별하기 어렵다[23]. 이 어려움에도 불구하고 호흡곤란을 일산화탄소 중독 증상에 포함한 이유는 저산소증 및 대사산증에 따른 중추신경계∙심혈관계 손상 정도는 대개 일산화탄소헤모글로빈 농도에 비례하기 때문이다[23]. 연구 대상자 중 중독 평가 및 고압산소요법을 목적으로 본원으로 전원된 환자가 포함된 점이 일산화탄소헤모글로빈 농도를 과소평가하는 데에 기여했을 수 있다. 상기 전원 과정에서 시간이 지체되고, 환자 1명은 고농도 산소요법 후 방문하여, 일산화탄소헤모글로빈 농도가 중독 직후보다 감소했을 것으로 추정한다.
본 연구를 통해 생활환경 변화에 따라 일산화탄소 노출 원인이 달라졌으며 신경학적 증상 발생 여부는 노출 시간에 차이가 있음을 알았다. 긴 노출 시간은 지연성 신경학적 합병증과도 연관 있으므로, 노출 시간과 신경학적 증상에 주의를 기울이는 것이 응급진료에 도움이 될 것으로 기대한다.
Notes
이해관계
본 저자는 이 논문과 관련된 이해관계가 없음.
Acknowledgements
본 연구는 2020년도 부산대학교병원 임상연구비 지원으로 이루어졌음.