응급실에 내원한 불완전 가와사키병 환아에서 심혈관 합병증을 예측하기 위한 인자로서 Pro-BNP의 유용성
Pro-brain natriuretic peptide as predictive factor for cardiovascular abnormalities in children with incomplete Kawasaki disease in emergency department
Article information
Trans Abstract
Purpose
The prevalence of incomplete Kawasaki disease (KD) is progressively increasing. The purpose of our study is to investigate the usefulness of pro-brain natriuretic peptide (pro-BNP) assay as a predictive biochemical marker of cardiovascular abnormality in children with incomplete KD.
Methods
We retrospectively reviewed medical records of patients under 15 years of age with incomplete KD in the pediatric emergency department (PED) of Soonchunhyang University Cheonan Hospital from January 2010 to December 2014. Incomplete KD was diagnosed in 132 children, including 67 boys and 65 girls, aged 2 to 83 months (mean, 24.9 months). We assessed the risk of cardiovascular abnormality in relation to age, gender, duration of fever, symptoms, and laboratory data.
Results
The distribution of epidemiologic characters, laboratory findings except platelet counts, and pro-BNP in the patient group without cardiovascular abnormality absent group did not significantly differ from those of the patient group with cardiovascular abnormality group. However, in the latter group with cardiovascular abnormality, serum platelet counts were significantly lower and concentration of pro-BNP levels were significantly higher.
Conclusion
Pro-BNP might be a useful and important value for predicting cardiovascular abnormality in incomplete KD at PED. Therefore, incomplete KD patients with high concentraton of pro-BNP need further evaluation for cardiovascular abnormality.
서 론
가와사키병은 영∙유아에서 발생하는 급성 전신성 혈관염으로 후천적인 심장질환의 원인이 된다. 여아보다는 남아에서 더 호발하며(남아:여아=1.5–1.7:1), 약 80%는 6개월에서 4세까지 발생하는 것으로 알려져 있다[1]. 가와사키병의 진단은 2004년 미국심장협회 가이드라인(American Heart Association Guideline)에서 발표한 임상 기준에 따르며[2], 5일 이상의 발열을 동반하면서 다음 5가지 임상 증상 중 4가지 이상 발현되었을 때 진단된다. 5가지 임상 증상에는 양안의 결막 충혈, 경부 림프절 비대, 다형 피부 발진, 입술과 구개 내 점막의 변화, 말초 사지의 변화 등이 있다. 하지만 이러한 조건을 모두 충족시키지 못하여 임상 증상으로 가와사키병을 의심하는 경우를 불완전 가와사키병이라 하며 이는 전체 가와사키병 환자 중 15%-20%에 달한다[1]. 이러한 경우 심혈관의 동맥류나 협착과 같은 합병증이 발생할 수 있으며 심할 경우 심인성 급사의 원인이 될 수도 있다.
Pro-brain natriuretic peptide (pro-BNP)는 성인에서 심부전 및 심근경색과 관련된 심실 기능부전을 반영하는 중요한 진단적 지표이면서 예후를 예측하는 인자로 사용되고 있으며, 소아에서도 선천성 심장병이나 심근증의 진단에 이용되고 있다.
따라서 본 연구는 가와사키병 의심 환자에서 심혈관 합병증의 발생과 관련된 인자들을 살펴보고 pro-BNP가 이를 예측하는 지표로 사용될 수 있는지의 여부를 알아보고자 하였다.
대상과 방법
2010년 1월부터 2014년 12월까지 응급실에 내원하여 가와사키병으로 진단되고 심초음파를 시행한 214명의 환자들에 대한 자료를 수집하였다. 이 중 20명은 의무기록이 충실히 작성되지 않아서, 이후 49명은 완전 가와사키병으로 진단되어서, 13명은 혈액검사가 불충분하여 배제되었다. 이에 총 132명의 불완전 가와사키병 의심 환자에 대한 분석을 시행하였다.
자료는 환자의 나이(개월), 성별, 심초음파의 시행 여부,심혈관 합병증 유무, 발열 일수, 가와사키병의 증상 유무 및 혈액검사 결과에 대해 수집하였다. 심혈관 합병증은 울혈성 심부전, 심근염, 심막염, 판막질환, 심혈관의 동맥류 및 확장으로 정의하였다.
통계분석은 SPSS ver. 14.0 (SPSS Inc., Chicago, IL, USA)을 사용하였다. 불완전 가와사키병 환자군에서 심혈관 합병증이 있는 군과 없는 군의 비교는 Student t-test와 chi-square test를 이용하였으며, 불완전 가와사키병에서의 심혈관 합병증 발생의 감별진단을 위한 pro-BNP의 진단적 유용성 분석을 위해 receiver operating characteristic (ROC) curve를 이용하였다. 통계적 유의수준은 P < 0.05로 하였다.
결 과
연구에는 67명의 남아(50.3%)와 65명의 여아(49.7%)가 포함되었고 그 비율은 1.03:1이었다. 진단 당시의 환아들의 나이는 2–83개월(평균값, 24.9개월)이었다.
심혈관 합병증이 발생한 군은 14명 이었고 해당 군의 평균연령은 21.2±14.2개월이었으며 남아가 9례(64.3%), 여아는 5례(35.7%)이었다. 심혈관 합병증이 발생하지 않은 군은 118명이었고 해당 군의 평균연령은 25.6±17.4개월이었으며 남아가 58례(49.2%), 여아는 60례(50.8%)이었다. 하지만 이 두 간의 연령과 성별은 심혈관 합병증의 발생 유무와 관련이 없었다(Table 1).

Clinical and biochemical characteristics of patients with normal coronary artery and cardiovascular abnormality (n=132)
혈액검사 상 심혈관 합병증이 발생한 군과 발생하지 않은 군 사이에 통계학적 차이를 보인 값은 혈소판수치와 pro-BNP였으며, 심혈관 합병증이 발생하지 않은 군과 발생한 군에서 각각 평균 혈소판 수치는 358.4±108.5×103/μL과 286.9±99.5×103/μL였으며 P = 0.022로 유의한 값을 보였다. 또한 pro-BNP의 경우 두 군에서 값이 각각 770.0±848.1 pg/mL과 1,782.1±1,849.5 pg/mL 이었다(P < 0.001) (Table 1). 심혈관 합병증이 발생한 군에서 pro-BNP의 평균값이 더 높았고(Fig. 1), 불완전 가와사키병에서의 심혈관 합병증 발생의 감별진단을 위한 pro-BNP의 ROC curve 아래의 면적은 0.701 (95% 신뢰구간, 0.546–0.856; P = 0.014)이었다. 또한 cut-off 값을 378.30로 정했을 때 민감도는 85.7%, 특이도는 42.4%이었다(Fig. 2).
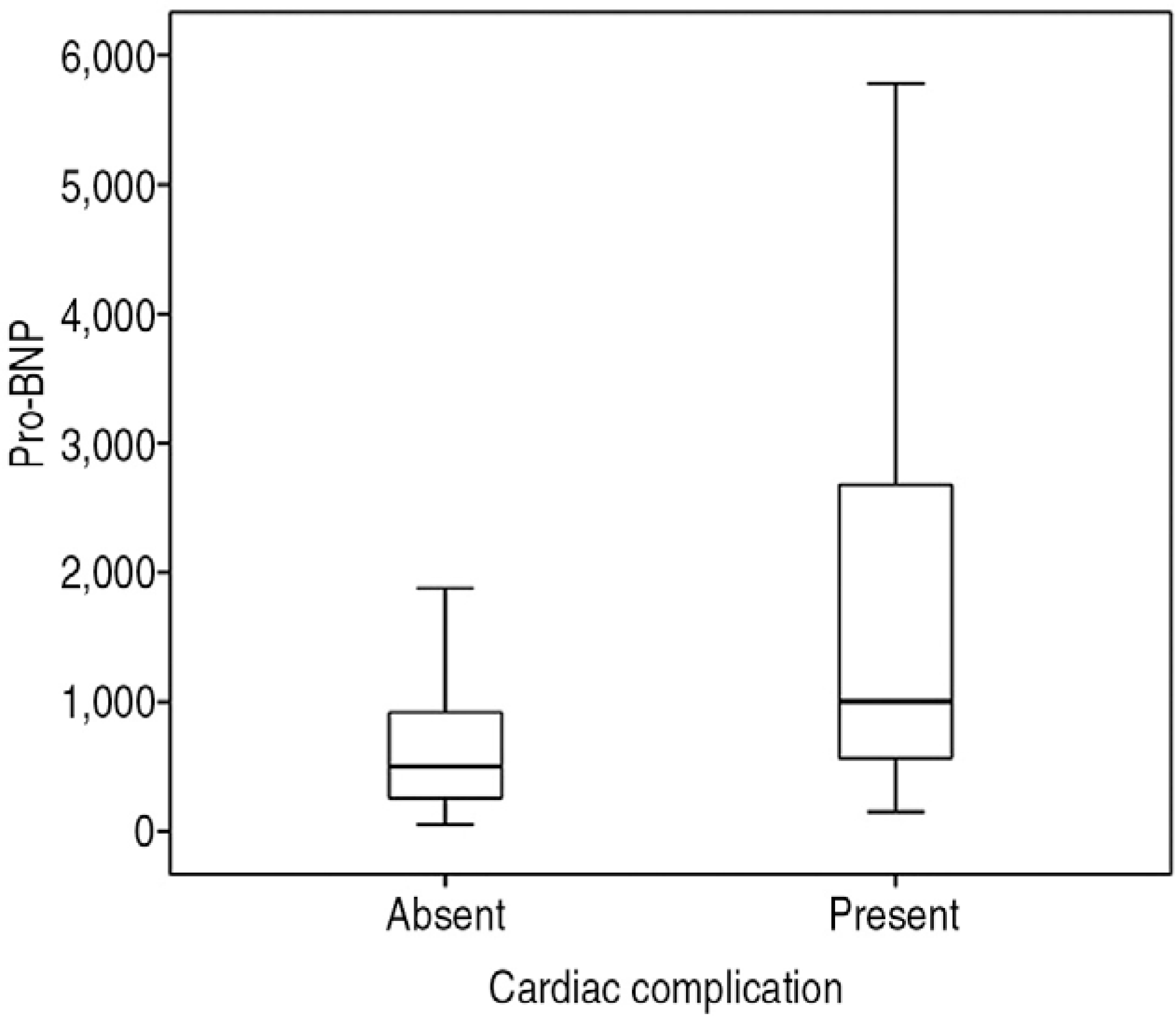
Comparison of pro-BNP concentration levels between patients with and without cardiovascular abnormality. pro-BNP: pro-brain natriuretic peptide.

Receiver operating characteristic curve for pro-brain natriuretic peptide in patients with cardiovascular abnormality due to incomplete Kawasaki disease.
Pro-BNP 수치에 따른 분포는 심혈관 합병증이 없는 군은 0–500 pg/mL에서 가장 많이 나타났고 심혈관 합병증이 발생한 군에서는 500–1,000 pg/mL에서 가장 호발하였지만 수치가 높아질수록 그 빈도가 증가하였으며 P = 0.003으로 유의하였다(Fig. 3). 하지만, 가와사키병의 특정 임상증상의 유무나 개수에 따른 pro-BNP 값의 차이는 없었다(Table 2).

Comparison of pro-brain natriuretic peptide concentration between patients with and without specific manifestations
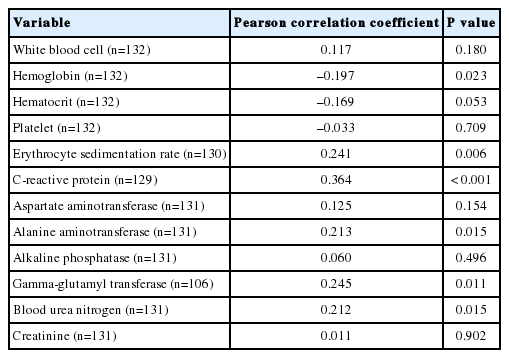
혈액검사 상 pro-BNP 값과 유의성을 보인 검사로는, 전체혈구계산 중 혈색소와 적혈구용적률이 있었고, 화학검사 상에서 알칼리성인산염분해효소(alkaline phosphatase)와 감마-글루타밀전이효소(gamma-glutamyl transferase)값이 있었다(Table 3).
고 찰
가와사키병은 20%에서 심혈관의 동맥류를 형성하며 5%에서 심근경색을 일으키고 1%에서 심인성 급사를 유발한다[3,4]. 최근 세계적으로 발생률이 증가하고 있기 때문에 그 임상적 중요성은 더욱 높아지고 있다[5–7].
가와사키병에서 남아와 여아의 발생 비율은 1.5–2:1 정도로 알려져 있으나, 본 연구에서는 거의 동일하였다. 또한 본 연구에서 불완전 가와사키병 환자에서 심혈관 합병증의 발생률은 132례 중 14례로 10.6% 정도로 나타났다. Pro-BNP는 심혈관 합병증을 보인 군에서 상승된 소견을 보였고, 심혈관 합병증의 예측 인자로서도 의미 있는 값을 보였다. 따라서 불완전 가와사키병을 진단 받은 환자에서 pro-BNP의 상승을 통해 심혈관 합병증을 예측할 수 있을 것으로 기대할 수 있다.
가와사키병에 있어 심혈관 합병증이 발생한 환자의 경우 약 20%에서 심혈관 협착이 발생하거나 침습적인 심혈관시술이 필요한데, 조기에 아스피린 및 정맥주사용 면역 글로불린으로 치료하였을 때 가와사키병의 심혈관 합병증의 발생률이 20–25%에서 3–5%로 감소하는 것으로 알려져 있다[1,8–11].
한편 pro-BNP는 심실근의 장력이나 심실충만압이 증가할 때 좌심실에서 분비되는 호르몬으로서, 심부전이나 심근경색 등 심실의 기능부전이 심할수록 혈중농도가 증가한다[12]. 따라서 가와사키병에서 심혈관계를 침범하는 경우 pro-BNP 농도가 증가한다면, 심혈관계 합병증 발생을 예측하는데 진단적 가치가 있다고 가정할 수 있다.
Pro-BNP와 그 N-terminal pro-BNP는 심근이 늘어나거나 심부전, 신부전, 또는 일차성 고알도스테론증의 경우와 같이 체액이 증가할 때, 그리고 심실비대나 허혈이 있을 때 좌심실에서 생성되고 분비되는 호르몬으로, 정상인에서는 매우 낮은 농도를 보인다[13,14].
한편 가와사키병의 급성기에는 pro-BNP가 증가하게 되는데, 그 이유로는 Kawamura 등[15]이 언급한 바와 같이 국소적인 심근의 염증 또는 허혈에 의한 것으로 생각할 수 있다. BNP는 심근경색에서 크게 증가한다고 알려져 있고, BNP의 합성과 분비는 심근의 괴사 혹은 심실에 대한 주변의 자극에 의해 증가된다고 Morita 등[16]이 언급하였다. 이를 통해 심근의 괴사 또는 허혈이 국소적일 때에도 BNP가 증가된다고 추정할 수 있다.
또한 급성기 가와사키병에서 pro-BNP가 증가하는 또 다른 기전으로 사이토카인의 역할을 들 수 있다. Tumor necrosis factor (TNF)-α 또는 interleukin (IL)-1β는 심근세포로부터 BNP의 분비를 유도한다고 보고되고 있다. 그리고 TNF-α, IL-1α, IL-1β와 interferon-β등의 사이토카인은 가와사키병 급성기에 증가하는 것으로 알려져 있다[16–20]. 특히 IL-1β는 BNP 전사를 자극하는 사이토카인으로 쥐의 심근세포를 배양한 실험에서 BNP 생성에 관여한다고 보고되고 있다. 이러한 사이토카인이 가와사키병 급성기에 심근염을 일으키고 BNP의 분비를 유도한다고 추정할 수 있다.
Dahdah 등[21]은 가와사키병과 비가와사키병 군에서 pro-BNP를 비교하여 가와사키병을 진단하기 위한 검사로서 유용성을 보여주었고, Cho 등[22]은 가와사키병을 진단하기 위한 검사로 pro-BNP와 C-reactive protein을 비교하여 pro-BNP가 가와사키병을 진단하는데 진단적 가치가 있으며 불완전 가와사키병을 진단하고 치료를 시작하는데 도움이 됨을 보여주었다. 하지만 심혈관 합병증 발생의 예측인자로서의 pro-BNP의 유용성에 대한 보고는 없었다. 따라서 본 연구에서는 불완전 가와사키병에서 심혈관 합병증에 대한 예측인자로서 pro-BNP의 유용성을 최초로 보여주었다는 의미가 있다. 또한 이러한 시도는 향후 가와사키병의 합병증을 예측하는데 유용할 것으로 생각한다.
하지만 본 연구는 단일 기관에서 수집된 자료를 바탕으로 시행된 연구이기 때문에 포함된 환자군이 제한적이라는 점과 의무기록 검토를 통해 후향적으로 진행되었다는 점에서, 자료를 선택함에 있어서 오차가 있을 수 있다. 따라서 추후 더 많은 환자군을 대상으로 하는 연구가 필요할 것으로 생각한다. 하지만 이러한 시도는 향후 가와사키병의 합병증을 예측하는데 유용한 정보를 제공할 것으로 생각한다.
결론적으로, 불완전 가와사키병의 신속한 진단과 심혈관 합병증 발생의 예측은 환자의 예후에 도움이 될 수 있으며, pro-BNP는 심혈관 합병증 발생의 예측인자로 이용될 수 있을 것이다.